Nitrat kislotasi
Nitrat kislota HNO3 - kuchli bir asosli kislota. Suvsizi beqaror suyuklik. Mol.m. 63,016. Suvsiz Nitrat kislotaning suyuqlanish temperaturasi — 41,59 °C, qaynash temperaturasi 84 °C, zichligi - 1,513 g/sm³. Nitrat kislota suv bilan istalgan nisbatda aralashadi. Suvsiz Nitrat kislota (98—100%li) xona haroratida tutab parchalanadi, bunda hosil boʻlgan NO2 dan havo sariq tusga kiradi.
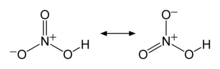
Nitrat kislota qaynatilganida ham parchalanadi:
Amalda zichligi 1,44 g/sm³ boʻlgan 63—65% li konsentrlangan kislota ishlatiladi. Nitrat kislota — kuchli oksidlovchi. Shu sababli metallarga taʼsir ettirilganda vodorod ajralib chiqmaydi. Konsentrlangan nitrat kislota qaytarilish mahsuloti har xil bo’lishi mumkin. Unga odatdagi sharoitda Fe, Al, Cr, Au va Pt ta’sir etmaydi. Cu, Ag va Ag ni eritib, o’zi NO2 ga qadar qaytariladi. Sn, As, P, B kislotalarigacha oksidlanadi:
Suyultirilgan nitrat kislotaning oksidlovchilik xossasi juda kuchli, ozi esa NO, NH4NO3 va boshqa mahsulotlargacha qaytariladi:
- 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
- 4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 5H2O
- PbS + 8HNO3 = 3PbSO4 + 4H2O + 8NO
- 3HCl + HNO3 = 2H2O + 2Cl2 + NOCl
Platina ham zar suvida (3HCl*HNO3) eriydi.
- 3Pt + 4HNO3 + 12HCl= 3PtCl4 + 4NO + 8H2O
Eng muhimi nitrat kislotaning metallar bilan reaksiyasida vodorod ajralmaydi. Agar nitrat kislotaga metallmaslar ta’sir ettirilsa metallmaslar kislotalargacha oksidlanadi:
- S+6HNO3(kons)=H2SO4+6NO2 +2H2O
Suyultirilgan nitrat kislota fosforni ortofosfat kislotagacha oksidlaydi:
- 3P+5HNO3+2H2O=3H3PO4+5NO
Uglerod nitrat kislota ta’sirida CO2 gacha oksidlanadi:
- 3C+4HNO3=3CO2 +2H2O+4NO
Nitrat kislota tuzlari suvda yaxshi eriydigan oq qattiq moddalar. Ular selitralar deyiladi. NaNO3 - natriyli, KNO3 - kaliyli, Ca(NO3)2 - kalsiyli, NH4NO3 - ammoniyli selitradir. Tuzlarining parchalanishi 3 xil: Eng aktiv metallarning (magniydan chapda turgan) nitratlari parchalansa nitritlar va kislorod hosil bo’ladi:
- 2KNO3 = 2KNO2 + O2
Agar metallning aktivligi kamroq va metall Mg va Cu orasida joylashgan bo’lsa bu metallarning nitratlari parchalanishida metal oksidi, NO2 va kislorod hosil bo’ladi. 2Zn(NO3)2 = 2ZnO + 4NO2 + O2 Agar metallar aktivligi kam bo’lsa, nitratlarning parchalanishida metallning o’zi, NO2 va kislorod hosil qiladi:
- 2AgNO3= Ag + 2NO2 + O2
Hg(NO3)2= Hg + 2NO2 + O2
Konsentrlangan nitrat kislota (HNO3) bilan xlorid kislota (HCl) aralashmasi, 1 hajm nitrat kislotaga 3 hajm xlorid kislota qoʻshilsa, "zar suvi" deb ataladigan kuchli oksidlovchi hosil bo'ladi:
- HNO3 + 3HCl = Cl2 + NOCl + 2H2O
Bu aralashma oltin va platinani hamda kislotalarda erimaydigan baʼzi metallarni eritadi. Labaratoriyada nitrat kislotaning tuzlariga yuqori konsentrasiyali sulfat kislota ta’sir ettirib olinadi:
- 2NaNO3 + H2SO4=Na2SO4 + 2HNO3 Nitrat kislota
Sanoat miqyosida nitrat kislota olish uchun asosiy xom ashyo ammiak va havo hisoblanadi:
- 4NH3+5O2=4NO+6H2O
- 2NO+O2=2NO2
Oksidlanish jarayoni 900 °C da Pt-Rh katalizatori ishtirokida olib boriladi. Boshqacha usulda azot va kisloroddan azot(II) oksidi, so’ngra uni NO2 gacha oksidlanishi ham mumkin. Hosil bo’lgan azot(IV) oksidi kislorod ishtirokida suvda eritiladi:
- 4NO2+O2+2H2O = 4HNO3
Azotli o’g’itlar. O’g’itlatlar sifatida kalsiy nitrat – Ca(NO3)2 ishlatiladi. Ohakni nitrat kislota bilan neytrallash natijasida olinadi. Natriy nitrat – NaNO3 chili selitrasi deyiladi. Tabiiy holda faqat Chilida juda katta zahira holda uchraydi. Kaliyli selitra - KNO3 hind selitrasi deyiladi. Suniy ravishda kaliy xlorid va natriy nitrat ta’siridan olinadi. Ammoniyli selitra - NH4NO3 ham ko’p ishlatiladi. Konsentrlangan Nitrat kislota portlovchi moddalar, sulfat va fosfat kislotalar, aromatik nitrobirikmalar, boʻyagichlar olishda ishlatiladi. Nitrat kislota bugʻi nafasga tegsa za-harlaydi, terini kuydiradi. Konsentrlangan Nitrat kislota organik moddalarga tekkanda portlaydi va yongʻin chiqadi.[1]
Manbalar
tahrir| Ushbu maqolada Oʻzbekiston milliy ensiklopediyasi (2000-2005) maʼlumotlaridan foydalanilgan. |

