Uglerod ftor bogʻlanishi
uglerod-ftor bogʻi a qutbli kovalent bogʻlanish orasidagi uglerod va ftor bu barcha organoflorin birikmalarining tarkibiy qismi. Bu kimyodagi eng kuchli bitta bogʻlanishlardan biridir (keyin B–F bitta bogʻlanish, Si–F bitta bogʻlanishva H–F bitta bogʻlanish) va qisman ion xarakteri tufayli nisbatan qisqa. Kimyoviy birikmada bir xil uglerodga koʻproq ftor qoʻshilishi bilan bogʻlanish ham kuchayadi va qisqaradi. Shunday qilib, ftoroalkanlar yoqadi tetraflorometan (tetraflorid uglerod) eng faol boʻlmagan organik birikmalardir.
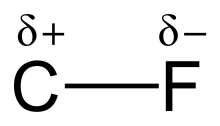
Elektromanfiylik va bogʻlanish kuchi
tahrirFtorning yuqori elektromanfiyligi (ftor uchun 4,0 va uglerod uchun 2,5) uglerod-ftor aloqasiga sezilarli qutblanish yoki dipol momentini beradi. Elektron zichligi ftor atrofida toʻplangan boʻlib, uglerod nisbatan kambagʻal elektronni qoldiradi. Bu qisman zaryadlar (C + — F −) orqali bogʻlanishga ion xarakterini kiritadi. Ftor va uglerodning qisman zaryadlari jozibador boʻlib, uglerod-ftor aloqasining gʻayrioddiy bogʻlanish kuchiga yordam beradi. Bogʻlanish „organik kimyodagi eng kuchli“[1] deb nomlanadi, chunki ftor uglerod bilan eng kuchli yagona aloqani hosil qiladi. Uglerod-ftor bogʻlari 130 kkal/mol gacha boʻlgan bogʻlanishning dissotsilanish energiyasiga (BDE) ega boʻlishi mumkin.[2] C-F ning BDE (bogʻning mustahkamligi) boshqa uglerod-galogen va uglerod-vodorod bogʻlardan yuqori. Masalan, CH 3 -X molekulasidagi C-X bogʻining BDEʼlari X = ftor, vodorod, xlor, brom va yod uchun mos ravishda 115, 104,9, 83,7, 72,1 va 57,6 kkal/mol ni tashkil qiladi.[3]
Bogʻlanish uzunligi
tahrirUglerod-ftor bogʻining uzunligi odatda taxminan 1,35 angström (ftormetanda 1,39 A) ni tashkil qiladi.[1] U har qanday boshqa uglerod-galogen bogʻlaridan qisqaroq va bitta uglerod- azot va uglerod- kislorod bogʻlaridan qisqaroq. Bogʻlanishning qisqa uzunligini bogʻlanishning ion xarakteriga ham bogʻlash mumkin (uglerod va ftorning qisman zaryadlari orasidagi elektrostatik tortishishlar). Uglerod-ftor bogʻlanish uzunligi uglerod atomining gibridlanishiga va uglerodda yoki hatto undan uzoqroqdagi atomlarda boshqa oʻrinbosarlarning mavjudligiga qarab bir necha yuzdan biriga oʻzgaradi. Ushbu dalgalanmalar nozik hibridizasyon oʻzgarishlari va stereoelektronik shovqinlarning belgisi sifatida ishlatilishi mumkin. Quyidagi jadval turli bogʻlanish muhitlarida oʻrtacha bogʻlanish uzunligi qanday oʻzgarishini koʻrsatadi (agar sp 2 yoki aromatik uglerod uchun boshqacha koʻrsatilmagan boʻlsa, uglerod atomlari sp 3 - gibridlangan).
Bogʻlanish uzunligining oʻzgaruvchanligi va qisman ion xarakteri tufayli ftor bilan bogʻlanishning qisqarishi ftor va boshqa elementlar orasidagi bogʻlanishlarda ham kuzatiladi va ftorning kovalent radiusi uchun mos qiymatni tanlashda qiyinchiliklar manbai boʻldi. Linus Pauling dastlab soat 18:00 ni taklif qilgan, ammo bu qiymat oxir-oqibat soat 72 ga almashtirildi, bu ftor-ftor bogʻlanish uzunligining yarmini tashkil etadi. Biroq, 72 pm ftor va boshqa elementlar orasidagi bogʻlanish uzunligini ifodalash uchun juda uzun, shuning uchun 17:00 dan 18:00 gacha boʻlgan qiymatlar boshqa mualliflar tomonidan taklif qilingan.[4][5][6][7]
Geminal bogʻlarning bogʻlanish mustahkamligi taʼsiri
tahrirXuddi shu (geminal) uglerodda ftor atomlari sonining koʻpayishi bilan boshqa aloqalar kuchliroq va qisqaroq boʻladi. Buni quyidagi jadvalda koʻrsatilganidek, florometan seriyasi uchun bogʻlanish uzunligi va mustahkamligidagi (BDE) oʻzgarishlar orqali koʻrish mumkin; shuningdek, atomlarning qisman zaryadlari (q C va q F) qator ichida oʻzgaradi.[2] Ftorlar qoʻshilganda uglerodning qisman zaryadi ijobiy boʻlib, ftor va uglerod oʻrtasidagi elektrostatik oʻzaro taʼsir va ion xarakterini oshiradi.
Gauche effekti
tahrirIkki ftor atomi 1,2- diftoroetan (H 2 FCCFH 2)dagi kabi vicinal (yaʼni qoʻshni) uglerodlarda boʻlsa, gauche konformeri antikonformatorga qaraganda barqarorroq boʻladi - bu odatda kutilganidan teskari va koʻpchilik 1,2-oʻrinbosar etanlar uchun nima kuzatiladi; Bu hodisa gauche effekti sifatida tanilgan.[8] 1,2-diftoroetanda gauche konformatsiyasi gaz fazasida 2,4 dan 3,4 kJ/molga anti konformatsiyaga qaraganda barqarorroqdir. Bu taʼsir faqat halogen ftorga xos emas; gauche effekti 1,2-dimetoksietan uchun ham kuzatiladi. Tegishli taʼsir alken cis effektidir. Masalan, 1,2-difloroetilenning sis izomeri trans izomeriga qaraganda barqarorroq.[9]
Gauche effekti uchun ikkita asosiy tushuntirish mavjud: giperkonjugatsiya va egilgan bogʻlanishlar. Giperkonjugatsiya modelida uglerod-vodorod s bogʻlovchi orbitaldan uglerod-ftor s * antibog 'orbitaliga elektron zichligi gauch izomeridagi barqarorlik manbai hisoblanadi. Ftorning elektromanfiyligi yuqori boʻlgani sababli, uglerod-vodorod s orbitali uglerod-ftor s orbitaliga qaraganda yaxshiroq elektron donor, uglerod-ftor s * orbitali esa uglerod-vodorod s * orbitaliga qaraganda yaxshiroq elektron qabul qiluvchi hisoblanadi. Faqat gauche konformatsiyasi yaxshi donor va yaxshi qabul qiluvchi oʻrtasida yaxshi moslashishga imkon beradi.[10]
Diftoroetandagi gauche taʼsirining egilgan bogʻlanish tushuntirishidagi kalit ftorning katta elektr manfiyligi tufayli ikkala uglerod-ftor bogʻlarining orbital p orbital xarakterining oshishi hisoblanadi. Natijada, elektron zichligi markaziy uglerod-uglerod aloqasining chap va oʻng tomonida yuqorida va pastda hosil boʻladi. Olingan qisqargan orbital qoplama, egilgan bogʻlanishni hosil qilib, gauche konformatsiyasi qabul qilinganda qisman qoplanishi mumkin. Ushbu ikkita modeldan giperkonjugatsiya odatda diftoroetandagi gauche effektining asosiy sababi hisoblanadi.[1][11]
Spektroskopiya
tahrirUglerod-ftor bogʻning choʻzilishi infraqizil spektrda 1000 va 1360 oraligʻida paydo boʻladi. sm −1. Keng diapazon choʻzilish chastotasining molekuladagi boshqa oʻrinbosarlarga nisbatan sezgirligi bilan bogʻliq. Monoflorli birikmalar 1000 dan 1110 gacha kuchli tarmoqqa ega sm -1 ; bir nechta ftor atomlari boʻlgan tarmoqli ikkita tarmoqqa boʻlinadi, biri nosimmetrik rejim uchun, ikkinchisi assimetrik.[12] Uglerod-ftor bantlari shunchalik kuchliki, ular mavjud boʻlishi mumkin boʻlgan har qanday uglerod-vodorod bantlarini yashirishi mumkin.[13]
Organoflorin birikmalari uglerod-13, ftor-19 (yagona tabiiy ftor izotopi) yoki vodorod-1 (agar mavjud boʻlsa) yordamida NMR spektroskopiyasi yordamida ham tavsiflanishi mumkin. <sup id="mw5A">19</sup> F NMR dagi kimyoviy siljishlar almashtirish darajasiga va funktsional guruhga qarab juda keng diapazonda namoyon boʻladi. Quyidagi jadvalda baʼzi asosiy sinflar uchun diapazonlar koʻrsatilgan.[14]
Yana qarang
tahrir- Organoflor kimyosi
- Ftoruglerod
Manbalar
tahrir- ↑ 1,0 1,1 1,2 O'Hagan D (2008-yil fevral). „Understanding organofluorine chemistry. An introduction to the C–F bond“. Chem Soc Rev. 37-jild, № 2. 308–19-bet. doi:10.1039/b711844a. PMID 18197347.
{{cite magazine}}: sana kiritilishi kerak boʻlgan parametrga berilgan qiymatni tekshirish lozim:|date=(yordam) - ↑ 2,0 2,1 Lemal, David M (2004). „Perspective on Fluorocarbon Chemistry“. J Org Chem. 69-jild, № 1. 1–11-bet. doi:10.1021/jo0302556. PMID 14703372.
- ↑ „Bond dissociation energies of organic molecules“. Acc. Chem. Res. 36-jild, № 4. 2003-yil aprel. 255–63-bet. doi:10.1021/ar020230d. PMID 12693923.
{{cite magazine}}: sana kiritilishi kerak boʻlgan parametrga berilgan qiymatni tekshirish lozim:|date=(yordam) - ↑ Gillespie Ronald; Robinson Edward (1992). „Bond Lengths in Covalent Fluorides. A New Value for the Covalent Radius of Fluorine“. Inorganic Chemistry. 31-jild, № 10. 1960–1963-bet. doi:10.1021/ic00036a045.
- ↑ Robinson Edward; Johnson Samuel; Tang Ting-Hua; Gillespie Ronald (1997). „Reinterpretation of the Lengths of Bonds to Fluorine in Terms of an Almost Ionic Model“. Inorganic Chemistry. 36-jild, № 14. 3022–3030-bet. doi:10.1021/ic961315b. PMID 11669953.
- ↑ Cordero Beatriz; Gómez Verónica; Platero-Prats Ana E; Revés Marc; Echeverría Jorge; Cremades Eduard; Barragán Flavia; Alvarez Santiago (2008). „Covalent radii revisited“. Dalton Trans. 2008-jild, № 21. 2832–2838-bet. doi:10.1039/b801115j. PMID 18478144.
- ↑ Pyykkö P.; Atsumi M. (2009). „Molecular Single-Bond Covalent Radii for Elements 1-118“. Chemistry: A European Journal. 15-jild, № 1. 186–197-bet. doi:10.1002/chem.200800987. PMID 19058281.
- ↑ Craig, Norman C.; Chen, Anthony; Suh, Ki Hwan; Klee, Stefan; Mellau, Georg C.; Winnewisser, Brenda P.; Winnewisser, Manfred (1997). „Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane“. J. Am. Chem. Soc. 119-jild, № 20. 4789–4790-bet. doi:10.1021/ja963819e.
- ↑ Bingham, Richard C. (1976). „The stereochemical consequences of electron delocalization in extended.pi. systems. An interpretation of the cis effect exhibited by 1,2-disubstituted ethylenes and related phenomena“. J. Am. Chem. Soc. 98-jild, № 2. 535–540-bet. doi:10.1021/ja00418a036.
- ↑ Alabugin, I. V. Stereoelectronic Effects: the Bridge between Structure and Reactivity. John Wiley & Sons Ltd, Chichester, UK, 2016
- ↑ Goodman, L.; Gu, H.; Pophristic, V (2005). „Gauche Effect in 1,2-Difluoroethane. Hyperconjugation, Bent Bonds, Steric Repulsion“. J. Phys. Chem. A. 109-jild, № 6. 1223–1229-bet. Bibcode:2005JPCA..109.1223G. doi:10.1021/jp046290d. PMID 16833433.
- ↑ George Socrates. Infrared and Raman characteristic group frequencies: tables and charts. John Wiley and Sons, 2001 — 198-bet. ISBN 978-0-470-09307-8.
- ↑ Barbara H. Stuart. Infrared Spectroscopy: Fundamentals and Applications. John Wiley and Sons, 2004 — 82-bet. ISBN 978-0-470-85428-0.
- ↑ „arxiv nusxasi“. 25-iyun 2010-yilda asl nusxadan arxivlangan. Qaraldi: 7-iyun 2022-yil.