Immunoglobulin M
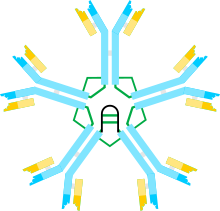
Immunoglobulinlar M (IgM)—antitellar sinfi boʻlib IgM molekulalari eng ogʻir (molekulyar ogʻirligi 990 kDa)[1] va eng murakkab tashkil etilgan immunoglobulinlar hisoblanadi. Erkin IgM molekulasi pentamer boʻlib, uning har bir monomeri ikkita ogʻir zanjir (m-zanjir) va k- yoki l-tipdagi ikkita engil zanjirdan tuzilgan. Monomerlar disulfid koʻpriklar va J-zanjirlar[2] orqali pentamer bilan bogʻlangan. Antigen organizmga birinchi marta kirganda, barcha antitelalardan birinchi boʻlib IgM immunoglobulinlari hosil boʻladi[3][4]. Bundan tashqari, ular birinchi boʻlib ontogenez va filogenezda paydo boʻladi. Odamlarda va boshqa sutemizuvchilarda IgM taloqda joylashgan plazma hujayralari tomonidan sintezlanadi[5][6]. IgM antibakterial immunitetda va bir qator autoimmun kasalliklarda eng faoldir hisoblanadi[2].
Oʻrganish tarixi
tahrirIgM immunoglobulinlarini oʻrganish 1937-yilda nashr etilgan xabarda pnevmokokk polisaxaridlari bilan giperimmunizatsiya qilingan otlarning qonida, anʼanaviy quyon immunoglobulinlari IgG massasidan sezilarli darajada oshib ketgan antitelalar haqidagi maqolaga bogʻliq[7]. Katta oʻlchamlari tufayli yangi antitelalar dastlab „y-makroglobulinlar“ deb nomlangan va yangi antitela sinfining keyingi nomi — IgM ham makro -prefiks bilan bogʻliq. Odatda, IgM populyatsiyalari juda xilma-xildir, chunki ular turli xil yuqumli agentlarga qaratilib; bu ularning tuzilishini oʻrganishga katta toʻsqinlik qiladi. Keyinchalik, bir xil IgM antitelalarining manbalari topildi. Maʼlum boʻlishicha, baʼzi hollarda miyelom koʻp hujayralari bir xil IgM ishlab chiqaradi[8]. 1960-yillarda immunoglobulinning rivojlanishini ragʻbatlantirish usullari ishlab chiqildi sichqonlarda oʻsmalar (plazmasitoma) ishlab chiqaradi. U koʻplab sinflar, jumladan IgM antitelalarining bir xil populyatsiyalarini olish imkonini berdi[9].
Tuzilishi
tahrirIgM molekulasi radial tarzda joylashgan, Fc boʻlaklari kompleks markaziga yoʻnaltirilgan, F ab-boʻlaklari esa tashqariga qaragan beshta monomer kichik boʻlinmalardan tuzilgan. Har bir monomerda ogʻir zanjir (μ-zanjir) 576 ga yaqin aminokislota qoldiqlarini . U taxminan 110 a. 110 a. uzunlikdagi oʻzgaruvchan domenni (VH-domeni) oʻz ichiga oladi va toʻrtta doimiy domenlar (C-domenlari), mos ravishda Cμ1, Cμ2, Cμ3 va Cμ4 bilan belgilanadi, lekin mentes hududiga ega emas. Funksional jihatdan u qisman Cμ2 domeni bilan almashtiriladi, u birlamchi strukturada prolin qoldiqlarini oʻz ichiga oladi. Ushbu domen mos ravishda G va A immunoglobulinlarining γ — va α-zanjirlarining menteşe mintaqasining evolyutsion kashshofi boʻlgan degan taxmin mavjud. Har bir C-domeni taxminan 110 a dan iborat. va taxminan 20 a. 20 a uzunlikdagi quyruq qismiga ega. Rentgen nurlari diffraktsiyasi tahliliga koʻra, Cμ2 domenidagi prolin qoldiqlari Fab fragmentiga antigen taqdim etuvchi yoki bakterial hujayra yuzasida antigenik determinantlarni aniqlash uchun zarur boʻlgan moslashuvchanlikni belgilab beradi. Har bir μ-zanjir asparagin qoldiqlariga biriktirilgan beshta oligosaxarid bilan bogʻlangan: biri Cμ1 domeniga, uchtasi Cμ3 domeniga va bittasi zanjirning dumiga[2] „tikilgan“[11]. Yengil zanjirlar esa λ — yoki kombinaturi bilan ifodalanadi, taxminan 220 a ni oʻz ichiga oladi va VL oʻzgaruvchan domenini oʻz ichiga oladi (taxminan 110 a. 110 a.) va CL doimiy domeni (taxminan 110 a. 110 a.)[12].
Bogʻlanishi
tahrirMonomerlar disulfid ko'prigi va J-zanjiri orqali pentamer hosil qilish uchun bogʻlanadi, ular bilan har bir pentamer monomerning C-terminal hududida joylashgan sistein qoldigʻi bilan oʻzaro taʼsir qiladi. J-zanjiri uzunligi taxminan 137 Da boʻlgan kichik, kislotali oqsillardir. IgM faqat pentamer shaklida mavjud boʻlganda J-zanjiri ikki m zanjirni disulfid bog‘lari orqali bog‘laydi. IgM ning monomerik shakli maʼlum, u B-limfotsitlar yuzasida joylashgan va antigenni aniqlovchi retseptor sifatida ishlaydi. Shuningdek, qon plazmasining bir qismi boʻlgan erkin IgM pentamer shaklida mavjud boʻlib, membrana monomerlari pentamerni tashkil etuvchi monomerlardan aminokislotalar zanjirining quyuq qismidagi aminokislotalar qoldiqlari soni bilan farqlanadi.[13][14]
Uchrashi
tahrirPentamer odamlar va sichqonlarda IgM ning asosiy shakli boʻlsa-da, tirnoqli qurbaqalar (''Xenopus'' sp.) IgM asosan geksamerik shaklda[15][16], teleost baliqlarida — tetramerik oqsil shaklda mavjud boʻladi. IgM ning pentamer shakli boʻyicha ham togʻay baliqlarda (masalan, akulalar)[17][18] ustunlik qiladi. Inson va sichqon IgM ning pentamerning asosiy shaklida uchrashi sababi aniq emas, chunki nazariy jihatdan barqaror geksamer ham hosil qilishi mumkin. Sichqonlar ustida olib borilgan tajribalar shuni koʻrsatdiki, ular μ-zanjirlarning J zanjiri[19] bilan oʻzaro taʼsiri imkonsiz boʻlsa (agar u ifodalanmagan boʻlsa yoki μ-da sistein qoldiqlari boʻlmasa, ular IgM ning geksamerik shaklini yaratishi mumkin. J-zanjirga bogʻlash uchun zarur boʻlgan zanjirlar)[20][21]. Shunday qilib, sichqonlarda geksamerlar J-zanjirlari ishtirokida hech qachon hosil boʻlmaydi va pentamer shakli J-zanjir borligida ham, uning yoʻqligida ham mavjud boʻlishi mumkin.[22].
Rentgen nurlarining difraksion tahlili va NMR spektroskopiyasi kabi turli usullardan foydalanib, Escherichia coli hujayralarida alohida ifodalangan Cμ1—Cμ4 domenlarining tuzilishi oʻrnatildi. Boshqa immunoglobulinlar singari kabi, IgM m-zanjirida domenlararo disulfid bogʻlari bilan bogʻlangan 7 ta bir-biriga oʻxshash beta-varaqlari mavjud. IgM doimiy hududi shakli boʻyicha qalpoqli qoʻziqoringa oʻxshaydi, unda Cμ2—Cμ3 domenlari „qopqoq“ ni,Cμ4 domeni esa oʻziga xos „oyoq“ ni tashkil qiladi[23].
Funksiyalari
tahrirIgM inson homilasida (taxminan 20-haftada) sintezlana boshlagan birinchi immunoglobulinlardir. IgM immunoglobulinlari komplement tizimining C1 komponenti bilan oʻzaro taʼsir qilishi va komplement tizimining klassik yoʻlini faollashtirishi mumkin, natijada antigen opsonizatsiyasi va sitolizi sodir boʻladi. IgM poliimmunoglobulin retseptorlari(plgR) molekulalari bilan oʻzaro taʼsir qiladi va shu bilan ichak shilliq qavatiga oʻxshab shilliq pardalarga, shuningdek, koʻkrak suti tarkibiga kiradi. Bu oʻzaro taʼsirda J-zanjirni bevosita ishtirok etadi[24]. Organlar transplantatsiyasi paytida retsipientning tanasi koʻchirilgan organga qarshi qaratilgan IgM ishlab chiqaradi[25], ammo ular transplantatsiyani rad etish reaktsiyasida qatnashmaydi va himoya rolini oʻynashi mumkin. Antigen bilan dastlabki toʻqnashuvda birinchi boʻlib IgM hosil boʻladi, ular takroriy toʻqnashuvlarda kamroq miqdorda ham paydo boʻladi. IgM platsentadan mustaqil oʻtolmaydi (faqat immunoglobulinlar G orqali oʻtadi). Baʼzi patogenlarga qarshi qon plazmasida IgM mavjudligi infektsiyaning dastlabki bosqichlarini va yangi tugʻilgan chaqaloqning qonida — bachadon ichi infektsiyani (masalan, Konjenital qizilcha sindromi) koʻrsatadi. Odatda, IgM koʻpincha qon plazmasida maʼlum antigenler bilan bogʻliq koʻrinishda mavjud boʻlib, ular uchun baʼzan „tabiiy antitelalar“ deb ataladi. Ushbu hodisaning sababi IgM ning yuqori ishtiyoqliligi boʻlib, buning natijasida ular sogʻlom odamning qon plazmasida topilgan past oʻzaro kross-reaktivlikka ega antigenlarni bogʻlaydi[26].
Yana qarang
tahrir
TurkumːAntitela TurkumːImmunologiya TurkumːImmunitet TurkumːMolekulyar biologiya
Manbalar
tahrir- ↑ Kabat E. A. THE MOLECULAR WEIGHT OF ANTIBODIES. (angl.) // The Journal Of Experimental Medicine. — 1939. — 1 January (vol. 69, no. 1). — P. 103—118. — doi:10.1084/jem.69.1.103. — PMID 19870830. [ispravit]
- ↑ 2,0 2,1 2,2 Галактионов 2004.
- ↑ „Immunoglobulin M“, The American Heritage Dictionary of the English Language. Andoza:Нп3, 2004. ISBN 978-0618082308.
- ↑ Alberts, B.; Johnson, A.; Lewis, J.; Walter, P.; Raff, M.; Roberts, K. „Chapter 24“, . Molecular Biology of the Cell, 4th, Routledge, 2002. ISBN 978-0-8153-3288-6.
- ↑ Williams, N.; O'Connell, P. R. „Chapter 62“, . Bailey & Love's Short Practice of Surgery, 25th, CRC Press, 2008 — 1102-bet. ISBN 9780340939321.
- ↑ Williams, N.; OʻConnell, P. R. Chapter 62 // Bailey & Loveʼs Short Practice of Surgery (angl.). — 25th. — CRC Press, 2008. — P. 1102. — ISBN 9780340939321.
- ↑ Heidelberger M., Pedersen K. O. THE MOLECULAR WEIGHT OF ANTIBODIES. (angl.) // The Journal Of Experimental Medicine. — 1937. — 28 February (vol. 65, no. 3). — P. 393—414. — doi:10.1084/jem.65.3.393. — PMID 19870608. [ispravit]
- ↑ https://dx.doi.org/10.1111/j.0954-6820.1944.tb03955.x
- ↑ Potter M. The early history of plasma cell tumors in mice, 1954-1976. (angl.) // Advances In Cancer Research. — 2007. — Vol. 98. — P. 17—51. — doi:10.1016/S0065-230X(06)98002-6. — PMID 17433907. [ispravit]
- ↑ Birgitta Heyman Marc, J.Shulman „Structure, Function, and Production of Immunoglobulin M (IgM)“. www.sciencedirect.com. Science Direct Journals & Books (2016). Qaraldi: 23-avgust 2022-yil.
- ↑ Галактионов В. Г. Иммунология., 2004, Москва: «Академия» — 528-bet. ISBN 5-7695-1260-1..
- ↑ Monica T. J., Williams S. B., Goochee C. F., Maiorella B. L. Characterization of the glycosylation of a human IgM produced by a human-mouse hybridoma. (angl.) // Glycobiology. — 1995. — March (vol. 5, no. 2). — P. 175—185. — doi:10.1093/glycob/5.2.175. — PMID 7780192. [ispravit]
- ↑ Галактионов, В. Г .. Иммунология, 2004, Москва: «Академия» — 66—67.-bet. ISBN 5-7695-1260-1..
- ↑ Frutiger S., Hughes G. J., Paquet N., Lüthy R., Jaton J. C. Disulfide bond assignment in human J chain and its covalent pairing with immunoglobulin M. (angl.) // Biochemistry. — 1992. — 22 December (vol. 31, no. 50). — P. 12643—12647. — doi:10.1021/bi00165a014. — PMID 1472500. [ispravit]
- ↑ Parkhouse R. M., Askonas B. A., Dourmashkin R. R. Electron microscopic studies of mouse immunoglobulin M; structure and reconstitution following reduction. (angl.) // Immunology. — 1970. — April (vol. 18, no. 4). — P. 575—584. — PMID 5421036. [ispravit]
- ↑ Schwager J., Hadji-Azimi I. Mitogen-induced B-cell differentiation in Xenopus laevis. (angl.) // Differentiation; Research In Biological Diversity. — 1984. — Vol. 27, no. 3. — P. 182—188. — doi:10.1111/j.1432-0436.1984.tb01426.x. — PMID 6334001. [ispravit]
- ↑ Fillatreau S., Six A., Magadan S., Castro R., Sunyer J. O., Boudinot P. The astonishing diversity of Ig classes and B cell repertoires in teleost fish. (angl.) // Frontiers In Immunology. — 2013. — Vol. 4. — P. 28—28. — doi:10.3389/fimmu.2013.00028. — PMID 23408183. [ispravit]
- ↑ Getahun A., Lundqvist M., Middleton D., Warr G., Pilström L. Influence of the mu-chain C-terminal sequence on polymerization of immunoglobulin M. (angl.) // Immunology. — 1999. — July (vol. 97, no. 3). — P. 408—413. — doi:10.1046/j.1365-2567.1999.00797.x. — PMID 10447761. [ispravit]
- ↑ Cattaneo A., Neuberger M. S. Polymeric immunoglobulin M is secreted by transfectants of non-lymphoid cells in the absence of immunoglobulin J chain. (angl.) // The EMBO Journal. — 1987. — September (vol. 6, no. 9). — P. 2753—2758. — PMID 3119328. [ispravit]
- ↑ Davis A. C., Roux K. H., Shulman M. J. On the structure of polymeric IgM. (angl.) // European Journal Of Immunology. — 1988. — July (vol. 18, no. 7). — P. 1001—1008. — doi:10.1002/eji.1830180705. — PMID 3136022. [ispravit]
- ↑ Davis A. C., Roux K. H., Pursey J., Shulman M. J. Intermolecular disulfide bonding in IgM: effects of replacing cysteine residues in the mu heavy chain. (angl.) // The EMBO Journal. — 1989. — September (vol. 8, no. 9). — P. 2519—2526. — PMID 2511005 [ispravit]
- ↑ Collins C., Tsui F. W., Shulman M. J. Differential activation of human and guinea pig complement by pentameric and hexameric IgM. (angl.) // European Journal Of Immunology. — 2002. — June (vol. 32, no. 6). — P. 1802—1810. — doi:10.1002/1521-4141(200206)32:6<1802::AID-IMMU1802>3.0.CO;2-C. — PMID 12115664. [ispravit]
- ↑ Müller R., Gräwert M. A., Kern T., Madl T., Peschek J., Sattler M., Groll M., Buchner J. High-resolution structures of the IgM Fc domains reveal principles of its hexamer formation. (angl.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2013. — 18 June (vol. 110, no. 25). — P. 10183—10188. — doi:10.1073/pnas.1300547110. — PMID 23733956. [ispravit]
- ↑ Johansen F. E., Braathen R., Brandtzaeg P. Role of J chain in secretory immunoglobulin formation. (angl.) // Scandinavian Journal Of Immunology. — 2000. — September (vol. 52, no. 3). — P. 240—248. — doi:10.1046/j.1365-3083.2000.00790.x. — PMID 10972899. [ispravit]
- ↑ McAlister C. C., Gao Z. H., McAlister V. C., Gupta R., Wright Jr. J. R., MacDonald A. S., Peltekian K. Protective anti-donor IgM production after crossmatch positive liver-kidney transplantation. (angl.) // Liver Transplantation : Official Publication Of The American Association For The Study Of Liver Diseases And The International Liver Transplantation Society. — 2004. — February (vol. 10, no. 2). — P. 315—319. — doi:10.1002/lt.20062. — PMID 14762873. [ispravit]
- ↑ Jayasekera J. P., Moseman E. A., Carroll M. C. Natural antibody and complement mediate neutralization of influenza virus in the absence of prior immunity. (angl.) // Journal Of Virology. — 2007. — April (vol. 81, no. 7). — P. 3487—3494. — doi:10.1128/JVI.02128-06. — PMID 17202212. [ispravit]